Lecția 17
Lecția 17 „Pregătirea de oxigen“ desigur „Chimie pentru manechine“ figura cum să obțineți oxigenul în laborator; Aflați ce un catalizator și plante afectează producția de oxigen pe planeta noastră.

Cel mai important pentru oameni și alte organisme vii, substanța, care face parte din aerul este oxigen. Cantități mari de oxigen sunt utilizate în industrie, de aceea este important să știi cum să-l primească.
Prepararea oxigenului in vitro
In oxigen laborator chimic poate fi produs prin încălzirea anumitor substanțe complexe care includ atomi de oxigen. Printre aceste substanțe se referă substanța KMnO4. care este disponibil în cabinetul dumneavoastră acasă medicament sub numele de „permanganat de potasiu“.
Sunteți familiarizat cu cele mai simple instrumente pentru gaze. Dacă unul dintre aceste dispozitive pentru a pune o pulbere KMnO4 puțin și încălzite, va elibera oxigen (Figura 76.):

Oxigenul poate fi obținut prin descompunerea peroxidului de hidrogen H2 O2. În acest scop, tubul conținând H2 O2 trebuie adăugat număr foarte mic de substante speciale - catalizator - și închideți dopul flaconului cu un tub de evacuare a gazului (Figura 77.).
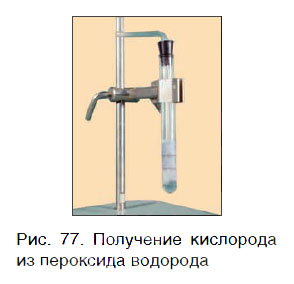
Pentru această reacție, catalizatorul este o substanță, a cărei formulă MnO2. Când acest lucru are loc următoarea reacție chimică:
Rețineți că nici în stânga, nici în partea dreaptă a ecuației nu există nici un catalizator. Formula sa este de obicei scrisă în ecuația reacției semnului egal. Pentru ce se adaugă catalizatorul? Procesul de descompunere a H2 O2 în condiții ambiante este foarte lent. Prin urmare, pentru a obține cantități apreciabile de oxigen necesită o mulțime de timp. Cu toate acestea, această reacție poate fi accelerată în mod dramatic prin adăugarea unui catalizator.
Catalizatorul - o substanță care accelerează o reacție chimică, dar nu în sine este consumat în ea.
Aceasta se datorează faptului că catalizatorul nu este consumat în reacție, nu scrie formula în oricare din părți ale ecuației reacției.
O altă modalitate de a obține oxigen - descompunerea apei sub influența unui curent electric constant. Acest proces este numit electroliza apei. Ia oxigenul poate fi în dispozitiv, prezentat schematic în figura 78.
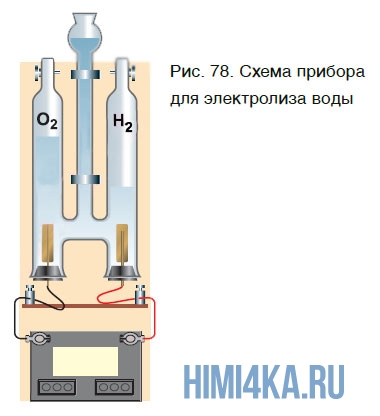
Când acest lucru are loc următoarea reacție chimică:
Oxigenul în natură
O mare cantitate de oxigen gazos conținut în atmosferă este dizolvat în apele mărilor și oceanelor. Oxigenul este esențial pentru toate organismele vii să respire. Fără oxigen, ar fi imposibil să se obțină energie prin arderea de combustibili diferiți. Aceste nevoi sunt cheltuite anual aproximativ 2% din oxigenul atmosferic.
Unde oxigenul pe Pământ și de ce suma rămâne aproximativ constantă, în ciuda acestor cheltuieli? Singura sursă de oxigen pe planeta noastră sunt plantele verzi pe care le produc sub actiunea razelor de soare prin fotosinteză. Acesta este un proces foarte complex, care implică mai multe etape. Ca rezultat al fotosintezei în verde bioxid de carbon și apă plante sunt transformate în glucoză și C6 H12 O6 oxigen. totalul
Ecuația reacțiilor care apar în procesul de fotosinteză, poate fi reprezentat după cum urmează:
Sa constatat că aproximativ o zecime (11%) de oxigen produs de plante verzi dau plantelor terestre, iar restul de nouă zecimi (89%) - plante acvatice.
Prepararea oxigen și azot din aer
Provizii uriașe de oxigen în atmosferă vă permit să primească și să-l utilizați într-o varietate de industrii. La scară industrială, oxigen, azot și alte gaze (argon, neon) se obține din aer.
În acest scop, aerul este mai întâi lichefiază (Fig. 79), prin răcire la o temperatură joasă, la care toate componentele sale în stare lichidă de agregare.

Apoi, acest lichid se încălzește lent, rezultând la temperaturi diferite sunt secvențial al vaporilor (m. E. Tranziția la starea gazoasă) substanțele conținute în aer. Colectarea gazelor de fierbere la temperaturi diferite, preparate separat, azot, oxigen, și alte substanțe.
Concluzii scurtă lecție:
- În condiții de laborator, oxigenul produs prin descompunerea anumitor substanțe complexe care includ atomi de oxigen.
- Catalizator - o substanță care accelerează reacția chimică, dar în sine nu este consumat.
- Sursa de oxigen de pe Pamant sunt plante verzi, în cazul în care are loc fotosinteza.
- In industrie, oxigenul se obține din aer.