Metale și compușii acestora
Reacție Ecuații pentru metale:
- a) substanțe simple: oxigen, hidrogen, halogeni, sulf, azot, carbon;
- b) substanțele complexe: apa, acizi, baze, săruri.
- K s-Metals includ elemente din grupele I și II, toate elementele s-si-elemente p din grupa III (cu excepția bor), precum și staniu și plumb (grupa IV), bismut (banda V) și poloniu (grupa VI). Metalele mai ales pe nivelul de energie de electroni exterior 1-3. D-elemente atomi în perioadele de la stânga la dreapta este umplut d-subnivele predvneshnego strat.
- Proprietățile chimice ale metalelor datorită structurii caracteristice a cochiliile electronice exterioare.
In perioada de crestere atomi raze miez de încărcare cu același număr de coji de electroni sunt reduse. Cele mai mari raze au atomi de metale alcaline. Raza mai mică atomic, cu cât energia de ionizare și mai mare raza atomica este cea mai mică energie de ionizare. Deoarece atomii metalici au cele mai mari atomi raze, acestea sunt caracterizate în primul rând valori scăzute ale energiei de ionizare și afinitatea de electroni. metale libere manifesta extrem de reducere a proprietăților.
3) metale formează oxizi, de exemplu:
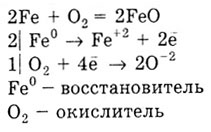
Acesta reacționează cu hidrogen numai metale alcaline și alcalino-pământoase care formează hidruri:
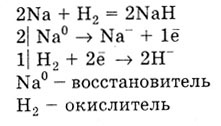
Metale reacționează cu halogeni formând halogenuri cu sulf - sulfuri, azot - nitruri, carbon - carburi.


Odată cu creșterea valorilor algebrice ale electrodului standard de potențial E 0 al metalului în seria electrochimică a metalului pentru a reacționa cu apa este redusa. Astfel, fierul reacționează cu apa numai la o temperatură foarte ridicată:

Metale cu un potențial pozitiv electrod etalon, adică în picioare după hidrogen în seria electrochimică nu reacționează cu apa.
Caracterizat prin reacția metalelor cu acizi. Metale cu o valoare negativă E 0 hidrogen stramuta din soluții de HCl, H 2 S0 4. H 3 P0 4 și altele asemenea. D.
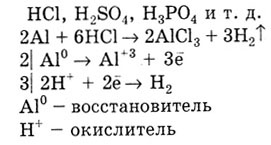
Metalul cu E0 inferior dislocă metalic cu o valoare mare de 0 E de soluții de sare:
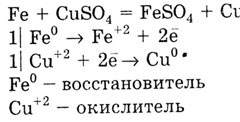
compus de calciu critic obținut în industrie, proprietățile lor chimice și metode de preparare.
a) reacționează cu apa pentru a elibera cantități mari de căldură:
CaO + H 2 0 = Ca (OH) 2 (var hidratat).
b) reacționează cu un acid pentru a forma o sare și apă;
CaO + 2H + = Ca2 + H 2 O
c) reacționează cu oxizii acizi pentru a forma săruri:
Hidroxid de calciu Ca (OH) 2 se utilizează sub formă de var stins, lapte de var si apa de var.
Lapte de var - suspensie este formată prin amestecarea unui exces de var stins cu apă.
Var Apa - soluție limpede obținută prin filtrarea laptelui de var. Folosit în laborator pentru detectarea monoxidului de carbon (IV).
Ca (OH) 2 + CO 2 = CaCO3 + H 2 O
Prelungit care trece cu monoxid de carbon (IV) pastvor devine transparent, ca sare a acidului format solubil în apă:
Dacă se încălzește soluția limpede rezultată de bicarbonat de calciu, din nou opacifierea apare deoarece cade SaS0 3 precipitat.