tabelul periodic
Secolul al XIX-lea din istoria omenirii - vârsta în care mulți reformat știință, inclusiv chimie. Acesta a fost în acest moment nu a existat un tabel periodic, și cu ea - și legea periodică. A devenit baza chimiei moderne. Periodic D. I. Mendeleeva Sistemul reprezintă elemente de sistematizare, care stabilește dependența proprietăților fizice și a structurii chimice a substanței și încărcătura atomului.
Începutul sistemului periodic a pus cartea „Valoarea proprietăților cu o greutate atomică de elemente“, scrisă în al treilea trimestru al secolului al XVII-lea. Acesta a fost afișat în raport cu conceptele de bază ale elementelor chimice cunoscute (la momentul respectiv existau doar 63). În plus, multe dintre greutăți atomice ele au fost determinate în mod incorect. Acest lucru a împiedicat foarte mult descoperirea D. I. Mendeleeva.

Dmitry Ivanovich a început activitatea prin compararea proprietatilor elementelor. În primul rând el a luat clor și potasiu, iar apoi mutat pentru a lucra cu metale alcaline. Înarmat cu carduri speciale pe care au fost reprezentate elemente chimice, a încercat de mai multe ori pentru a aduna „mozaic“: a pus pe biroul lui, în căutare de combinații potrivite și a meciurilor.
După mult efort, Dmitry Ivanovich găsi în continuare modelul care a fost în căutarea și elemente într-o serie periodică construite. Rezultând într-o celulă goală între elementele, omul de știință a realizat că cercetătorii români nu cunosc toate elementele chimice, și că el ar trebui să dea lumii cunoștințele în domeniul chimiei, care nu a fost încă dat de predecesorii săi.
Toată lumea este familiarizat cu mitul că tabelul periodic Mendeleev a fost într-un vis, iar el a adunat din elemente de memorie într-un singur sistem. Acest lucru este, aproximativ vorbind, o minciună. Faptul că Dmitry Ivanovich pentru o lungă perioadă de timp și concentrat de lucru pe munca lui, și este puternic obositor. În timp ce lucrează la un sistem de elemente Mendeleev o dată a adormit. Trezindu-se, el a dat seama că el nu a terminat masa, și în curând a continuat să umple celulele goale. familiar lui, unii străini, un profesor universitar, a decis că tabelul periodic a avut un vis într-un vis, iar zvonul a circulat printre elevii lor. Deci, a existat această ipoteză.
faimă
Structura și regulile elementelor de cazare
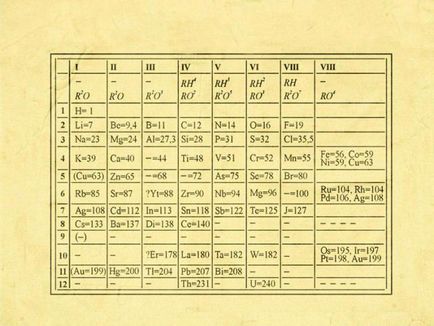
Primii pași în crearea legii periodice au fost făcute de Dmitry Ivanovich înapoi în 1869-1871 de ani, în timp ce a lucrat intens la stabilirea dependența proprietăților elementelor de date din masa atomului. Versiunea modernă este amestecată cu un tabel bidimensional de elemente.
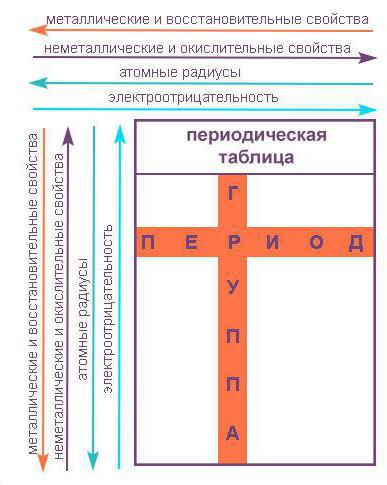
Poziția elementului în tabel presupune un anumit sens chimic și fizic. La locația elementului în tabel puteți afla ce valența lui, se determină numărul de electroni și alte proprietăți chimice. Dmitry Ivanovich a încercat să stabilească o legătură între elementele ca fiind similar cu reciproc, în proprietățile lor și diferite.
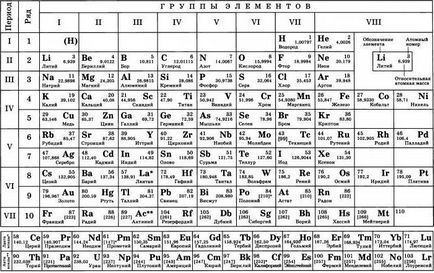
Clasificarea este cunoscută în momentul elementelor chimice, el a pus o valență și greutatea atomică. Comparând proprietățile relative ale elementelor Mendeleev a fost încercarea de a găsi un model, care ar reuni toate elementele chimice cunoscute într-un singur sistem. Plasarea acestora pe baza creșterii maselor atomice, el a atins încă frecvența în fiecare dintre rânduri.
Dezvoltarea în continuare a sistemului
tabelul periodic din nou și din nou, a apărut a fi finalizat în 1969. Odată cu apariția de gaze nobile în 1930 sa dovedit a descoperi cele mai recente dependența elementelor - nu din masele, și numărul de serie. Mai târziu, în măsură să stabilească numărul de protoni din nucleu atomic, și a constatat că acesta coincide cu numărul de serie al elementului. Oamenii de știință ai secolului XX structura electronică a atomului a fost studiată. Sa dovedit că aceasta afectează frecvența. Acest lucru se schimba foarte mult percepția elementelor de proprietăți. Acest element a fost reflectat în edițiile mai recente ale sistemului periodic lui Mendeleev. Fiecare nouă descoperire a proprietăților și caracteristicile elementelor se potrivesc perfect în tabel.
Caracteristicile tabelului periodic
Tabelul periodic este împărțit în perioade (7 linii dispuse orizontal), care la rândul lor sunt împărțite în mari și mici. Perioada de la un metal alcalin, și se încheie cu nemetalice proprietăți membre.
Vertically tabel Mendeleev este împărțit în grupe (8 coloane). Fiecare dintre ele în tabelul periodic format din două subgrupe - și anume, principal și secundar. După multe dezbateri cu privire la propunerea D. I. Mendeleeva și colegii lui W. Ramsay, sa decis să introducă un așa-numitul grup de la zero. Acesta include gaze inerte (heliu, neon, argon, radon, xenon, cripton). In 1911, cercetătorul Soddy a fost propus pentru a plasa în sistemul periodic al elementelor și imperceptibile, așa numiții izotopi - au fost izolate pentru celulele lor individuale.

În ciuda fidelitatea și acuratețea sistemului periodic, comunitatea științifică nu a vrut să recunoască această descoperire. Mulți oameni de știință au ridiculizat activitatea D. I. Mendeleeva, și a crezut că este imposibil de prezis proprietățile unui element care nu a fost încă deschis. Dar, după presupusele elemente chimice au fost descoperite (și a fost, de exemplu, scandiu, galiu și germaniu), sistemul periodic lui Mendeleev și legile sale au devenit baza teoretică a științei chimiei.
Tabel în prezent
Sistemul periodic Mendeleev elementelor - baza majorității descoperirilor chimice și fizice referitoare la doctrina atomice și moleculare. Conceptul modern al unui element sa întâmplat doar din cauza marelui om de știință. Apariția tabelului periodic a adus schimbări drastice în prezentarea diferiților compuși și substanțe simple. Oamenii de stiinta creationisti sistemului periodic a avut o influență profundă asupra dezvoltării chimiei și științelor, aliat.
